导读:化学是一门以实验为基础的学科,实验题目考点的分值逐年增多,考点的内容、形式、灵活多变,试题类型有文字和表格,还有文字、表格、图形、数据综合的综合题。在此,长沙新东方整理分享了2019长沙中考化学必背知识点总结:化学规律,以供学习与参考,希望对大家有所帮助。
1、金属活动性顺序:
金属活动性顺序由强至弱: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(按顺序背诵) 钾钙钠镁铝 锌铁锡铅(氢) 铜汞银铂金
①金属位置越靠前的活动性越强,越易失去电子变为离子,反应速率越快
②排在氢前面的金属能置换酸里的氢,排在氢后的金属不能置换酸里的氢,跟酸不反应;
③排在前面的金属,能把排在后面的金属从它们的盐溶液里置换出来。排在后面的金属跟排在前面的金属的盐溶液不反应。
④混合盐溶液与一种金属发生置换反应的顺序是“先远”“后近”
注意:*单质铁在置换反应中总是变为+2价的亚铁
2、金属+酸→盐+H2↑中:
①等质量金属跟足量酸反应,放出氢气由多至少的顺序:Al>Mg>Fe>Zn②等质量的不同酸跟足量的金属反应,酸的相对分子质量越小放出氢气越多。
③等质量的同种酸跟足量的不同金属反应,放出的氢气一样多。
3、干冰不是冰是固态二氧化碳;水银不是银是汞;铅笔不是铅是石墨
纯碱不是碱是盐(碳酸钠);塑钢不是钢是塑料。
4、物质的检验
(1) 酸(H+)检验。
方法1将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变红,则证明H+存在。
方法2用干燥清洁的玻璃棒蘸取未知液滴在蓝色石蕊试纸上,如果蓝色试纸变红,则证明H+的存在。
方法3用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH小于7,则证明H+的存在。
(2) 碱(OH-)的检验。
方法1将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变蓝,则证明OH-的存在。
方法2用干燥清洁的玻璃棒蘸取未知液滴在红色石蕊试纸上,如果红色石蕊试纸变蓝,则证明OH-的存在。
方法3将无色的酚酞试液滴入盛有少量待测液的试管中,振荡,如果酚酞试液变红,则证明OH-的存在。
方法4用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH大于7,则证明OH-的存在。
(3)CO32- 或HCO3-的检验。
将少量的盐酸或硝酸倒入盛有少量待测物的试管中,如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试管中,如果石灰水变浑,则证明原待测物中CO32-或HCO3-的存在。
(4)铵盐(NH4+):
用浓NaOH溶液(微热)产生使湿润的红色石蕊试纸变蓝的气体。
5、金属+盐溶液→新金属+新盐:
①金属的相对原子质量>新金属的相对原子质量时,反应后溶液的质量变重,金属变轻。
②金属的相对原子质量<新金属的相对原子质量时,反应后溶液的质量变轻,金属变重。
③在金属+酸→盐+H2↑反应后,溶液质量变重,金属变轻。
6、物质燃烧时的影响因素:
①氧气的浓度不同,生成物也不同。如:碳在氧气充足时生成二氧化碳,不充足时生成一氧化碳。
②氧气的浓度不同,现象也不同。如:硫在空气中燃烧是淡蓝色火焰,在纯氧中是蓝色火焰。
③氧气的浓度不同,反应程度也不同。如:铁能在纯氧中燃烧,在空气中不燃烧。
④物质的接触面积不同,燃烧程度也不同。如:煤球的燃烧与蜂窝煤的燃烧。
7、影响物质溶解的因素:
①搅拌或振荡。搅拌或振荡可以加快物质溶解的速度。
②升温。温度升高可以加快物质溶解的速度。
③溶剂。选用的溶剂不同物质的溶解性也不同。
8、元素周期表的规律:
①同一周期中的元素电子层数相同,从左至右核电荷数、质子数、核外电子数依次递增。
②同一族中的元素核外电子数相同、元素的化学性质相似,从上至下核电荷数、质子数、电子层数依次递增。
9、原子结构知识中的八种决定关系:
①质子数决定原子核所带的电荷数(核电荷数)
因为原子中质子数=核电荷数。
②质子数决定元素的种类
③质子数、中子数决定原子的相对原子质量
因为原子中质子数+中子数=原子的相对原子质量。
④电子能量的高低决定电子运动区域距离原子核的远近
因为离核越近的电子能量越低,越远的能量越高。
⑤原子最外层的电子数决定元素的类别
因为原子最外层的电子数<4为金属,>或=4为非金属,=8(第一层为最外层时=2)为稀有气体元素。
⑥原子最外层的电子数决定元素的化学性质
因为原子最外层的电子数<4为失电子,>或=4为得电子,=8(第一层为最外层时=2)为稳定。
⑦原子最外层的电子数决定元素的化合价
原子失电子后元素显正价,得电子后元素显负价,化合价数值=得失电子数
⑧原子最外层的电子数决定离子所带的电荷数
原子失电子后为阳离子,得电子后为阴离子,电荷数=得失电子数
10、初中化学实验中的“先”与“后”
①使用托盘天平使用托盘天平时,首先要调节平衡。调节平衡时,先把游码移到零刻度,然后转动平衡螺母到达平衡。
②加热使用试管或烧瓶给药品加热时,先预热,然后集中加热。
③制取气体制取气体时,必须先检查装置的气密性,然后装药品。
④固体和液体的混合固体液体相互混合或反应时,要先加入固体,然后加入液体。
⑤试验可燃性气体在试验氢气等的可燃性时,要先检验氢气等气体的纯度,然后试验其可燃性等性质。
⑥氧化还原反应用还原性的气体(如H2、CO)还原氧化铜等固体物质时,一般需要加热。实验时,要先通一会儿气体,然后再加热。实验完毕,继续通氢气,先移去酒精灯直到试管冷却,然后再移去导气管。
⑦稀释浓硫酸稀释浓硫酸时,先往烧杯里加入蒸馏水,然后沿烧杯壁慢慢注入浓硫酸,并用玻璃棒不断搅拌,冷却后装瓶。
⑧分离混合物用重结晶的方法分离食盐和硝酸钾的混合物,当食盐占相当多量时,可以先加热蒸发饱和溶液,析出食盐晶体,过滤,然后再冷却母液析出硝酸钾晶体;当硝酸钾占相当多量时,可以先冷却热饱和溶液,析出硝酸钾晶体,过滤,然后再蒸发母液,析出食盐晶体。
⑨中和滴定在做中和滴定的实验时,待测溶液一般选用碱溶液,应先向待测溶液中加入酚酞试剂,使之显红色,然后逐滴加入酸溶液,搅拌,直至红色恰好退去。
⑩除去混合气体中的二氧化碳和水蒸气除去混合气体中的二氧化碳和水蒸气时,应把混合气体先通过盛有浓氢氧化钠溶液的洗气瓶,然后接着通过盛有浓硫酸的洗气瓶。
⑾检验混合气体中是否混有二氧化碳和水蒸气在检验混合气体中是否混有二氧化碳和水蒸气时,应把混合气体先通过盛有无水硫酸铜的干燥管,然后再通过盛有石灰水的洗气瓶。
⑿金属和盐溶液的置换反应混合溶液与一种金属发生置换反应的顺序是“先远”“后近”;金属混合物与一种盐溶液发生置换反应的顺序也是“先远”“后近”。
11、反应中的一些规律:
①跟盐酸反应产生能澄清石灰水变浑浊的气体的一定是CO32-(也可能为HCO3- 离子,但一般不予以考虑)◆ 凡碳酸盐与酸都能反应产生CO2气体
②跟碱反应能产生使湿润红色石蕊试纸变蓝的气体(NH3)的,一定为NH4+(即为铵盐)。
●溶于水显碱性的气体只有NH3(NH3+H2O=NH3·H2O)
③可溶性的碳酸盐加热不能分解,只有不溶性碳酸盐受热才能分解。CaCO3=CaO+CO2↑
酸式碳酸盐也不稳定,受热易分解:2NaHCO3=Na2CO3+H2O+CO2↑
12、实验中的规律:
①凡用固体加热制取气体的都选用高锰酸钾制O2装置(固固加热型);
凡用固体与液体反应且不需加热制气体的都选用双氧水制O2装置(固液不加热型)。
②凡是给试管固体加热,都要先预热,试管口都应略向下倾斜。
③凡是生成的气体难溶于水(不与水反应)的,都可用排水法收集。
凡是生成的气体密度比空气大的,都可用向上排空气法收集。
凡是生成的气体密度比空气小的,都可用向下排空气法收集。
④凡是制气体实验时,先要检查装置的气密性,导管应露出橡皮塞1-2ml,铁夹应夹在距管口1/3处。
⑤凡是用长颈漏斗制气体实验时,长颈漏斗的末端管口应插入液面下。
⑥凡是点燃可燃性气体时,一定先要检验它的纯度。
⑦凡是使用有毒气体做实验时,最后一定要处理尾气。
⑧凡是使用还原性气体还原金属氧化物时,一定是“一通、二点、三灭、四停”
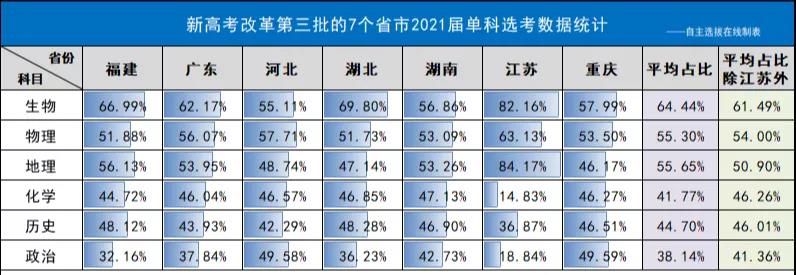
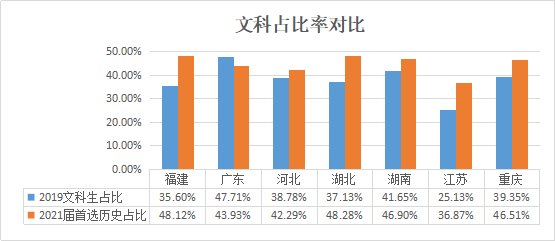
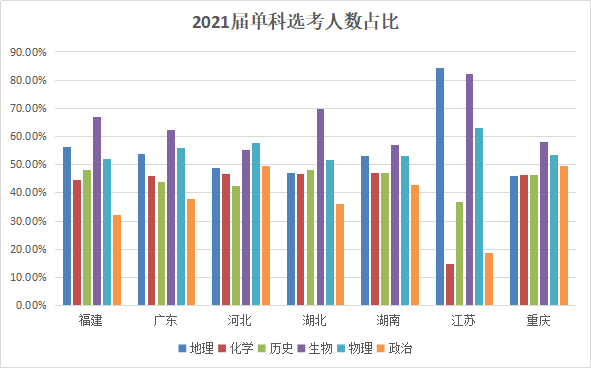


















 京公网安备11010802021790号
京公网安备11010802021790号









 学习资料
学习资料
