导读:“工艺流程题”紧密联系工业生产和社会生活实际,这样的题型对于考生来说试题综合性强,涉及的知识点多,对学生能力的要求大,试题文字多,信息量大,多数学生会感到解题困难,得分率不高。高中化学工业制法与方程式包括:合成氨、石油化工、氯碱工业、硫酸的工业制法、苏打、亚硝酸钠、二氧化硫、甲烷、乙烯、乙炔等的制法。
氯气(氯碱工业)

制取原理——强氧化剂氧化含氧化合物
制取方程式——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
装置——分液漏斗,圆底烧瓶,加热
检验——能使湿润的蓝色石蕊试纸先变红后褪色;
除杂质——先通入饱和食盐水(除HCl),再通入浓H2SO4(除水蒸气)
收集——排饱和食盐水法或向上排气法
尾气回收——Cl2+2NaOH=== NaCl+NaClO+H2O
石油化工
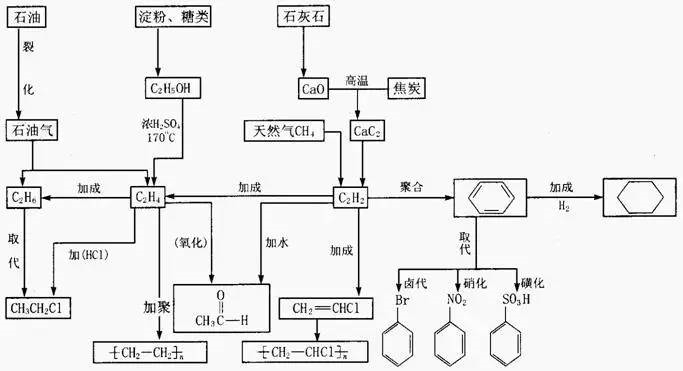
氨气(合成氨)

①制取原理——固体铵盐与固体强碱的复分解
②制取方程式——Ca(OH)2+2NH4ClCaCl2+NH3↑+2H2O
③装置——略微向下倾斜的大试管,加热
④检验——湿润的红色石蕊试纸,变蓝
⑤除杂质——通入碱石灰(除水蒸气)
收集——向下排气法
硫酸的工业制法

苏打
苏打是Soda的音译,化学式为Na2CO3。它的名字颇多,学名叫碳酸钠,俗名除叫苏打外,又称纯碱或苏打粉。带有结晶水的叫水合碳酸钠,有一水碳酸钠(Na2CO3·H2O)、七水碳酸钠(Na2CO3·7H2O)和十水碳酸钠(Na2CO3·10H2O)三种。十水碳酸钠又叫洗濯苏打、洗濯碱或晶碱。
无水碳酸钠是白色粉末或细粒,易溶于水,水溶液呈碱性。它有很强的吸湿性,在空气中能吸收水分而结成硬块。十水碳酸钠是无色晶体,室温下放置空气中,会失去结晶水而成为一水碳酸钠。无论十水碳酸钠还是一水碳酸钠,加热都会变成无水碳酸钠。碳酸钠很稳定,受热不易分解。遇酸能放出二氧化碳:Na2CO3+2HCl====2NaCl+H2O+CO2↑
碳酸钠溶液还能吸收二氧化碳而成碳酸氢钠:Na2CO3+H2O+CO2====2NaHCO3
在三种苏打中,碳酸钠的用途最广。它是一种十分重要的化工产品,是玻璃、肥皂、纺织、造纸、制革等工业的重要原料。冶金工业以及净化水也都用到它。它还可用于其他钠化合物的制造。早在十八世纪,它就和硫酸、盐酸、硝酸、烧碱并列为基础化工原料--三酸两碱之一。在日常生活中,苏打也有很多用途,比如它可以直接作为洗涤剂使用,在蒸馒头时加一些苏打,可以中和发酵过程中产生的酸性物质。
亚硝酸钠
NaNO2性质和用途:白色或微黄色斜方晶体,易溶于水和液氨中,微溶于甲醇、乙醇、乙醚,吸湿性强,用于织物染色的媒染剂;丝绸、亚麻的漂白剂,金属热处理剂;钢材缓蚀剂;氰化物中毒的解毒剂,实验室分析试剂,在肉类制品加工中用作发色剂、防微生物剂,防腐剂。密度2.168g/cm3,熔点271℃,于320℃分解。吸湿,易溶于水,水溶液稳定,表现碱性反应,可从空气中吸收氧气,并形成硝酸钠。亚硝酸钠有毒,并且是致癌物质,在亚硝酸钠分子中,氮的氧化数是+3。是一种中间氧化态,既有还原性又有氧化性,例如在酸性溶液中能将KI氧化成单质碘:
这个反应可以定量地进行,可用于测定亚硝酸盐。亚硝酸钠大量用在染料工业和有机合成中,常用于制备偶氮染料、氧化氮、药物、防锈剂以及印染、漂白、腌肉等方面,因为它有毒,使用时必须注意。亚硝酸钠的热稳定性高,可用高温热还原法备:Pb(粉)+NaNO3=PbO+NaNO2
产物PbO不溶于水,将反应后混合物溶于热水中,过滤、重结晶,得到白色晶状的亚硝酸钠。
氧化还原性:(NO2)-中的N为+3价,所以既有氧化性,又有还原性。在酸性介质中:HNO2/NO=0.99V,有较强的氧化能力。(NO2)-+2I-+4H+==2NO+I2+2H2O
因在酸中有NO+存在,易得电子成NO,故很容易将I-氧化。这是亚硝酸和稀硝酸的区别反应。硝酸盐的酸性溶液,不能将I-氧化,是由于上述动力学原因所至。遇强氧化剂时,也有还原性。
5(NO2)-+2(MnO4)-+6H+====5(NO3)-+(Mn)2++3H2O
在无氧化剂和还原剂时,易歧化。亚硝酸钠也作为食品的增色剂,用于肉类食品。但是由于其致癌性,不允许超标。
硫化氢
①制取原理——强酸与强碱的复分解反应
②制取方程式——FeS+2HCl===FeCl2+H2S↑
③装置——启普发生器
④检验——能使湿润的醋酸铅试纸变黑
⑤除杂质——先通入饱和NaHS溶液(除HCl),再通入固体CaCl2(或P2O5)(除
水蒸气)
⑥收集——向上排气法
二氧化硫
①制取原理——稳定性强酸与不稳定性弱酸盐的复分解
②制取方程式——Na2SO3+H2SO4=== Na2SO4+SO2↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——先通入品红试液,褪色,后加热又恢复原红色;
⑤除杂质——通入浓H2SO4(除水蒸气)
⑥收集——向上排气法
氯化氢
①制取原理——高沸点酸与金属氯化物的复分解
②制取方程式——NaCl+H2SO4Na2SO4+2HCl↑
③装置——分液漏斗,圆底烧瓶,加热
④检验——通入AgNO3溶液,产生白色沉淀,再加稀HNO3沉淀不溶
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——向上排气法
二氧化氮
①制取原理——不活泼金属与浓硝酸的氧化—还原;
②制取方程式——Cu+4HNO3===Cu(NO3)2+2NO2↑+2H2O
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——红棕色气体,通入AgNO3溶液颜色变浅,但无沉淀生成
⑤收集——向上排气法
⑥尾气处理——3NO2+H2O===2HNO3+NO
NO+NO2+2NaOH===2NaNO2+H2O
一氧化碳
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——HCOOHCO↑+H2O
③装置——分液漏斗,圆底烧瓶
④检验——燃烧,蓝色火焰,无水珠,产生气体能使澄清石灰水变浑浊
⑤除杂质——通入浓硫酸(除水蒸气)
⑥收集——排水法
甲烷
①制取方程式——CH3COONa+NaOH CH4↑+Na2CO3
②装置——略微向下倾斜的大试管,加热
③收集——排水法或向下排空气法
乙烯
①制取原理——浓硫酸对有机物的脱水作用
②制取方程式——CH3CH2OH CH2=CH2↑+H2O
③装置——分液漏斗,圆底烧瓶,加热
④除杂质——通入NaOH溶液(除SO2,CO2),通入浓硫酸(除水蒸气)
收集——排水法
乙炔
①制取原理——电石强烈吸水作用
②制取方程式——CaC2+2H2OCa(OH)2+CH CH↑
③装置——分液漏斗,圆底烧瓶(或用大试管,锥形瓶)
④检验——无色气体,能燃烧,产生明亮的火焰,并冒出浓的黑烟
⑤除杂质——通入硫酸铜溶液(除H2S,PH3),通入浓硫酸(除水蒸气)
延伸阅读:
2019高三寒假学习计划
2019年高考纲各科考试大纲汇总
2019高考化学工业生产设计与分析
2019高考化学创新实验的分析
2019高考化学物质检验、净化、制备
2019高考化学实验仪器使用与操作






















 京公网安备11010802021790号
京公网安备11010802021790号









 学习资料
学习资料
